FDA aprova Merilog, primeiro biossimilar de insulina rápida
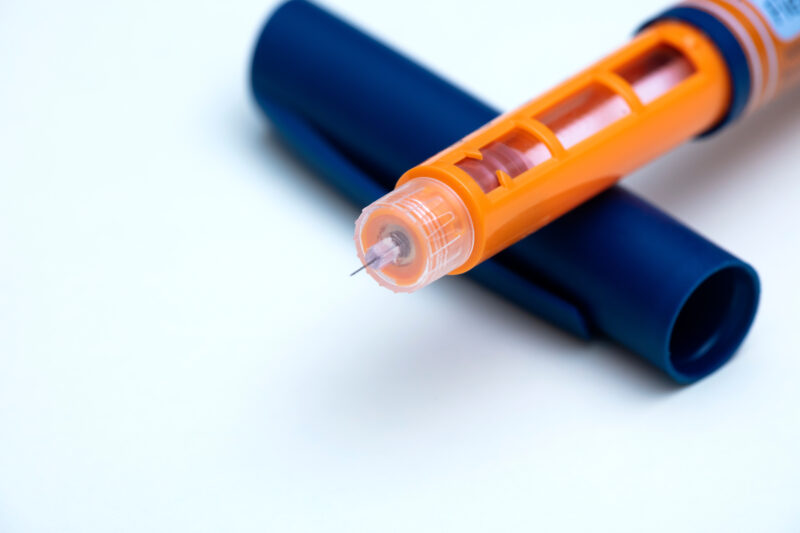
A Food and Drug Administration (FDA), agência reguladora dos Estados Unidos, aprovou o Merilog, primeiro biossimilar de insulina de ação rápida para o tratamento da diabetes mellitus em adultos e crianças. O medicamento, produzido pela Sanofi-Aventis, foi autorizado em fevereiro e promete ampliar o acesso à insulina com menor custo, mantendo qualidade e eficácia comprovadas.
FDA atualiza definição de alimentos saudáveis nos EUA
O Merilog é indicado para controle glicêmico durante as refeições, devendo ser aplicado de cinco a dez minutos antes da ingestão de alimentos. Diferente dos biossimilares de insulina de ação prolongada já aprovados pelo FDA, como o Semglee em 2021, ele atua rapidamente para evitar picos de açúcar no sangue.
Nos Estados Unidos, cerca de 38 milhões de pessoas têm diabetes, e aproximadamente 8,4 milhões necessitam de tratamento com insulina. Com a aprovação do Merilog, a expectativa é que mais pacientes tenham acesso a uma alternativa de menor custo.
O medicamento será disponibilizado em caneta de uso único (3 ml) e frasco para doses múltiplas (10 ml). Entre os possíveis efeitos colaterais estão hipoglicemia, reações alérgicas, hipocalemia (níveis baixos de potássio no sangue), além de coceira, erupção cutânea, inchaço e ganho de peso.
Consumo de iogurte é associado a redução do risco de diabetes tipo 2
A FDA já aprovou 65 biossimilares nos últimos anos para diferentes condições de saúde. Esses medicamentos são desenvolvidos após a expiração da patente do fármaco original, garantindo concorrência no mercado e tornando os tratamentos mais acessíveis.
Fonte: Futuro da Saúde
Imagem: Reprodução